WskazaniaLeczenie miejscowe łuszczycy owłosionej skóry głowy u dorosłych. Miejscowe leczenie łuszczycy plackowatej o przebiegu łagodnym do umiarkowanego u dorosłych.DawkowanieProdukt leczniczy należy stosować na chorobowo zmienioną skórę raz/dobę. Zalecany okres leczenia skóry owłosionej wynosi 4 tyg. a pozostałych obszarów skóry 8 tyg. Jeśli po tym czasie konieczne jest kontynuowanie lub ponowne rozpoczęcie leczenia, należy je podjąć po kontroli lekarskiej i pod regularnym nadzorem lekarza. Podczas stosowania produktów leczniczych zawierających kalcypotriol maksymalna dawka dobowa nie powinna przekraczać 15 g. Powierzchnia skóry leczonej produktami leczniczymi zawierającymi kalcypotriol nie powinna przekraczać 30% pc. W przypadku stosowania na owłosionej skórze głowy. Produktem leczniczym w postaci żelu można leczyć miejsca na owłosionej skórze głowy dotkniętej łuszczycą. Zazwyczaj od 1-4 g żelu/dobę wystarcza do leczenia owłosionej skóry głowy (4 g żelu odpowiada zawartości 1 łyżeczki). Zaburzenia czynności nerek i wątroby. Nie badano bezpieczeństwa i skuteczności stosowania produktu leczniczego, żel u pacjentów z ciężką niewydolnością nerek i u pacjentów z ciężkimi zaburzeniami czynności wątroby. Dzieci i młodzież. Nie określono bezpieczeństwa ani skuteczności produktu leczniczego u dzieci w wieku poniżej 18 lat. Aktualne dane dotyczące dzieci w wieku 12-17 lat, patrz ChPL Brak zaleceń dotyczących dawkowania. W przypadku występowania łuszczycy owłosionej skóry głowy. Przed nałożeniem produktu leczniczego na skórę głowy należy przeczesać włosy, aby usunąć wszelkie luźne łuski. Należy przechylić głowę, aby upewnić się, że produkt leczniczy nie spływa po twarzy. Pomocne może być przedzielenie włosów przed użyciem produktu leczniczego. Produkt leczniczy należy nałożyć opuszkami palców na obszar dotknięty łuszczycą i delikatnie wmasować. Jeśli konieczne, należy powtórzyć raz lub dwa razy kroki 4-6. Czas trwania leczenia. Żel należy stosować raz/dobę. Wygodniejsze może być używanie żelu wieczorem. Zwykle początkowy okres leczenia wynosi 4 tyg. na obszarach owłosionej skóry głowy i 8 tyg. na pozostałych obszarach skóry. Lekarz może zdecydować o innym okresie leczenia. Lekarz może podjąć decyzję o powtórzeniu leczenia. Nie należy stosować więcej niż 15 g leku/dobę. W przypadku stosowania innych produktów leczniczych zawierających kalcypotriol całkowita ilość produktów leczniczych zawierających kalcypotriol nie może przekraczać 15 g/dobę, natomiast obszar leczonej skóry nie powinien przekraczać 30% całkowitej pc.UwagiPodanie na skórę. Nie należy nakładać żelu bezpośrednio na twarz ani oczy. W celu uzyskania optymalnego działania nie zaleca się korzystania z prysznica czy kąpieli ani mycia włosów w przypadku stosowania żelu na skórę głowy bezpośrednio po nałożeniu produktu leczniczego. Żel powinien pozostać na skórze przez całą noc lub dzień. Należy wstrząsnąć zawartością tuby przed zastosowaniem i nałożeniem żelu na dotknięty chorobą obszar skóry. Po użyciu produktu leczniczego należy umyć ręce. Instrukcja właściwego stosowania. Produkt leczniczy powinien być stosowany wyłącznie na skórę objętą łuszczycą a nie na skórę bez łuszczycy. Należy wstrząsnąć tubą przed użyciem i zdjąć nakrętkę. Należy wycisnąć żel na czysty palec lub bezpośrednio na obszar skóry objęty łuszczycą. Produkt leczniczy należy nałożyć palcami na obszar skóry objętej łuszczycą i delikatnie rozprowadzić, aż skóra objęta łuszczycą zostanie przykryta cienką warstwą żelu. Nie należy bandażować, szczelnie przykrywać ani owijać leczonej skóry.Należy dobrze umyć ręce po użyciu produktu leczniczego. To pozwoli zapobiec przypadkowemu przedostaniu się żelu na inne części ciała (zwłaszcza twarz, usta i oczy). Jeśli trochę żelu przypadkowo dostanie się na zdrową skórę w pobliżu obszaru objętego łuszczycą i rozprzestrzeni się za daleko, należy go zetrzeć. W celu uzyskania optymalnego działania nie zaleca się korzystania z prysznica czy kąpieli bezpośrednio po nałożeniu produktu leczniczego żel. Po zastosowaniu żelu należy unikać kontaktu z tekstyliami, które łatwo ulegają zabrudzeniu tłuszczem.PrzeciwwskazaniaNadwrażliwość na substancje czynne lub na którąkolwiek substancję pomocniczą. Produkt leczniczy jest przeciwwskazany u pacjentów z erytrodermią łuszczycową, łuszczycą złuszczającą i łuszczycą krostkową. Ze względu na zawartość kalcypotriolu nie należy stosować produktu leczniczego u pacjentów ze stwierdzonymi zaburzeniami metabolizmu wapnia. Ze względu na zawartość kortykosteroidu produkt leczniczy jest przeciwwskazany w następujących przypadkach: wirusowe zakażenia skóry (np. opryszczka lub ospa wietrzna), grzybicze lub bakteryjne zakażenia skóry, zarażenia pasożytnicze, zmiany skórne w przebiegu gruźlicy, okołowargowe zapalenie skóry, atrofia skóry, rozstępy skóry, łamliwość żył skórnych, rybia łuska, trądzik pospolity, trądzik różowaty, owrzodzenia i rany.Ostrzeżenia specjalne / Środki ostrożnościWpływ na układ wydzielania wewnętrznego. Produkt leczniczy zawiera silnie działający steroid z grupy III, w związku z czym należy unikać jego jednoczesnego stosowania z innymi steroidami. W czasie stosowania miejscowo kortykosteroidów mogą również wystąpić działania niepożądane występujące w przypadku stosowania kortykosteroidów o działaniu ogólnym, takie jak supresja czynności kory nadnerczy lub wpływ na metaboliczną kontrolę cukrzycy, co jest związane z wchłanianiem układowym. Należy unikać stosowania produktu leczniczego pod opatrunkami okluzyjnymi, ponieważ zwiększa to układowe wchłanianie kortykosteroidów. Należy unikać stosowania produktu leczniczego na dużych powierzchniach uszkodzonej skóry, błonach śluzowych i na fałdach skóry, ponieważ zwiększa to układowe wchłanianie kortykosteroidów. W badaniu pacjentów z rozległą łuszczycą owłosionej skóry głowy i skóry tułowia z zastosowaniem w skojarzeniu dużych dawek kalcypotriolu z betametazonem, (50 mg + 0,5 mg)/g, żel (na owłosioną skórę głowy) i dużych dawek kalcypotriolu z betametazonem, (50 mg + 0,5 mg)/g, maść (na tułów/ciało), po 4 tyg. leczenia u 5 z 32 pacjentów stwierdzono graniczny spadek odpowiedzi kortyzolu na test prowokacji z podaniem hormonu adrenokortykotropowego (ACTH). Zaburzenia widzenia. Zaburzenia widzenia mogą wystąpić w wyniku ogólnoustrojowego i miejscowego stosowania kortykosteroidów. Jeżeli u pacjenta wystąpią takie objawy jak nieostre widzenie lub inne zaburzenia widzenia, należy rozważyć skierowanie go do okulisty w celu ustalenia możliwych przyczyn, do których może należeć: zaćma, jaskra lub rzadkie choroby, takie jak centralna surowicza chorioretinopatia (CSCR), którą zgłaszano po ogólnoustrojowym i miejscowym stosowaniu kortykosteroidów. Wpływ na metabolizm wapnia. Ze względu na zawartość kalcypotriolu, gdy przekroczona zostanie maksymalna dobowa dawka (15 g), może wystąpić hiperkalcemia. Po przerwaniu leczenia stężenie wapnia we krwi powraca do wartości prawidłowych. Ryzyko hiperkalcemii jest minimalne, gdy są przestrzegane zalecenia dotyczące stosowania kalcypotriolu. Należy unikać stosowania produktu leczniczego na więcej niż 30% powierzchni skóry. Miejscowe działania niepożądane. Produkt leczniczy zawiera silny kortykosteroid (grupa III), dlatego trzeba unikać jednoczesnego stosowania innych steroidów na tej samej powierzchni skóry. Skóra twarzy i narządów płciowych jest bardzo wrażliwa na kortykosteroidy. Nie należy stosować tego produktu leczniczego na te okolice. Pacjent musi być poinformowany o prawidłowym sposobie stosowania produktu leczniczego, aby uniknąć podawania i przypadkowego przeniesienia żelu na twarz, usta i oczy. Po każdorazowym nałożeniu produktu leczniczego na skórę należy dokładnie umyć ręce, aby uniknąć przypadkowego kontaktu z tymi obszarami. Jednocześnie występujące zakażenia skóry. W przypadku wtórnego nadkażenia zmian skórnych należy zastosować leczenie przeciwbakteryjne. Niemniej jednak w razie nasilenia zakażenia należy przerwać leczenie kortykosteroidami. Przerwanie leczenia. Podczas leczenia łuszczycy miejscowo stosowanymi kortykosteroidami istnieje ryzyko wystąpienia uogólnionej łuszczycy krostkowej lub efektu „z odbicia” po zaprzestaniu terapii. Dlatego w okresie po zakończeniu leczenia wskazany jest nadzór lekarza. Długotrwałe stosowanie. Podczas długotrwałego stosowania zwiększa się ryzyko wystąpienia miejscowych i ogólnych działań niepożądanych kortykosteroidów. Należy przerwać leczenie, jeśli wystąpią działania niepożądane związane z długotrwałym stosowaniem kortykosteroidów. Brak doświadczeń ze stosowaniem produktu leczniczego w leczeniu łuszczycy kropelkowej. Jednoczesne leczenie innymi produktami leczniczymi i promieniowaniem ultrafioletowym. W leczeniu zmian łuszczycowych owłosionej skóry głowy zastosowano maść zawierającą kalcypotriol + betametazon, (50 mg + 0,5 mg)/g w skojarzeniu z produktem leczniczym w postaci żelu zawierającym kalcypotriol + betametazon, (50 mg + 0,5 mg)/g w leczeniu zmian łuszczycowych na ciele, ale doświadczenia dotyczące stosowania kalcypotriolu + betametazon (50 mg + 0,5 mg)/g, żel w skojarzeniu z innymi przeciwłuszczycowymi produktami leczniczymi działającymi miejscowo, podawanymi na to samo miejsce, z przeciwłuszczycowymi produktami leczniczymi o działaniu ogólnym lub z fototerapią są ograniczone. Podczas leczenia z zastosowaniem produktu leczniczego lekarze prowadzący powinni doradzać pacjentom ograniczenie lub też unikanie nadmiernej ekspozycji na promieniowanie słoneczne lub sztuczne źródła promieniowania słonecznego. Miejscowe stosowanie kalcypotriolu w połączeniu z napromieniowaniem UV jest możliwe jedynie w sytuacji, gdy lekarz i pacjent uznają, że korzyści przewyższają potencjalne ryzyko. Działania niepożądane związane z substancjami pomocniczymi. Produkt leczniczy zawiera jako substancję pomocniczą butylohydroksytoluen (E 321), który może powodować miejscowe reakcje skórne (np. kontaktowe zapalenie skóry) lub podrażnienie oczu i błon śluzowych. Produkt leczniczy zawiera olej rycynowy uwodorniony jako substancję pomocniczą, który może wywołać miejscowe reakcje skórne. Produkt leczniczy nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn.InterakcjeNie przeprowadzono badań dotyczących interakcji z produktem leczniczym.Ciąża i laktacjaBrak odpowiednich danych dotyczących stosowania produktu leczniczego zawierającego kalcypotriol + betametazon (50 mg + 0,5 mg)/g, żel, u kobiet w ciąży. Badania na zwierzętach z zastosowaniem glikokortykosteroidów wykazały ich toksyczne działanie na rozrodczość, jednak badania epidemiologiczne (w mniej niż 300 zakończonych rozwiązaniem ciążach) nie wykazały wad wrodzonych u niemowląt urodzonych przez kobiety leczone kortykosteroidami w trakcie ciąży. Potencjalne ryzyko u ludzi jest niepewne. Dlatego też w okresie ciąży produkt leczniczy powinien być stosowany wyłącznie wtedy, gdy potencjalne korzyści przewyższają potencjalne ryzyko. Betametazon przenika do mleka matki, jednak ryzyko niepożądanego działania na dziecko wydaje się mało prawdopodobne w przypadku stosowania dawek leczniczych. Nie ma danych dotyczących przenikania kalcypotriolu do mleka matki. Należy zachować ostrożność w przypadku, kiedy produkt leczniczy jest przepisywany kobietom karmiącym piersią. Pacjentkę należy pouczyć, że w okresie karmienia piersią nie wolno stosować produktu leczniczego na piersi. Badania polegające na podawaniu szczurom doustnych dawek kalcypotriolu lub betametazonu dipropionianu nie wykazały zaburzenia płodności u osobników płci męskiej i żeńskiej.Działania niepożądaneOcena częstości występowania działań niepożądanych została przeprowadzona na podstawie analizy zbiorczej danych z badań klinicznych, w tym badań dotyczących bezpieczeństwa prowadzonych po dopuszczeniu produktu leczniczego do obrotu oraz ze zgłoszeń spontanicznych. Najczęściej zgłaszanym działaniem niepożądanym, obserwowanym podczas leczenia, był świąd. Zakażenia i zarażenia pasożytnicze: (niezbyt często) zakażenia skóry, zapalenie mieszków włosowych. Zaburzenia układu immunologicznego: (rzadko) nadwrażliwość. Zaburzenia oka: (niezbyt często) podrażnienie oka, (nieznana) nieostre widzenie. Zaburzenia skóry i tkanki podskórnej: (często) świąd, (niezbyt często) zaostrzenie łuszczycy, zapalenie skóry, rumień, wysypka, trądzik, uczucie pieczenia skóry, podrażnienie skóry, suchość skóry; (rzadko) rozstępy skórne, złuszczanie się skóry; (nieznana) zmiany koloru włosów (zgłaszano przemijające przebarwienia włosów do żółtawego koloru w miejscu podania na owłosionej skórze głowy na białych lub siwych włosach). Zaburzenia ogólne i stany w miejscu podania: (niezbyt często) ból w miejscu podania (uczucie pieczenia w miejscu podania, w tym ból w miejscu podania); (rzadko) efekt z odbicia. Uważa się, że wymienione poniżej działania niepożądane są związane z grupą farmakologiczną odpowiednio kalcypotriolu i betametazonu. Kalcypotriol. Działania niepożądane obejmują: reakcje w miejscu podania, świąd, podrażnienie skóry, pieczenie i uczucie kłucia, suchość skóry, rumień, wysypkę, zapalenie skóry, wyprysk, nasilenie łuszczycy, nadwrażliwość na światło oraz reakcje nadwrażliwości, w tym bardzo rzadkie przypadki obrzęku naczynioruchowego i obrzęku twarzy. Działania układowe po zastosowaniu miejscowym mogą pojawiać się bardzo rzadko, powodując hiperkalcemię lub hiperkalciurię. Betametazon (w postaci betametazonu dipropionianu). Po zastosowaniu miejscowym produktu leczniczego mogą wystąpić reakcje miejscowe, zwłaszcza podczas długotrwałego stosowania, obejmujące zaniki skóry, teleangiektazje, rozstępy, zapalenie mieszków włosowych, nadmierne owłosienie, zapalenie wokół warg, alergiczne kontaktowe zapalenie skóry, odbarwienia i prosaki koloidowe. W trakcie leczenia łuszczycy kortykosteroidami przeznaczonymi do stosowania miejscowego istnieje ryzyko wystąpienia uogólnionej łuszczycy krostkowej. Reakcje układowe po miejscowym zastosowaniu kortykosteroidów występują u dorosłych rzadko, ale mogą być ciężkie. Może wystąpić zahamowanie czynności kory nadnerczy, zaćma, zakażenia, wpływ na wyrównanie metaboliczne cukrzycy i wzrost ciśnienia w gałce ocznej, zwłaszcza po długotrwałym stosowaniu. Reakcje układowe występują częściej, jeżeli produkt leczniczy stosuje się pod opatrunkiem okluzyjnym (folia, fałdy skóry) albo kiedy stosowany jest długotrwale oraz na duże powierzchnie skóry. Dzieci i młodzież. Nie zaobserwowano istotnych klinicznie różnic między profilami bezpieczeństwa w populacji dorosłych i młodzieży. W trzech otwartych badaniach klinicznych leczono łącznie 216 nastolatków.PrzedawkowanieStosowanie dawek większych niż zalecane może prowadzić do nadmiernego zwiększenia stężenia wapnia w surowicy, które po przerwaniu stosowania produktu leczniczego powraca do wartości prawidłowych. Objawy hiperkalcemii to: poliuria, zaparcia, osłabienie mięśni, zaburzenia orientacji i śpiączka. Długotrwałe miejscowe stosowanie kortykosteroidów może hamować czynność osi przysadka - nadnercza, co prowadzi zwykle do odwracalnej wtórnej niedoczynności nadnerczy. W takich przypadkach wskazane jest zastosowanie leczenia objawowego. W razie przewlekłego zatrucia leczenie kortykosteroidami należy odstawiać stopniowo. Donoszono, że u jednego z pacjentów z rozległą erytrodermią łuszczycową, u którego omyłkowo zastosowano maść zawierającą kalcypotriol + betametazon, (50 mg + 0,5 mg)/g w ilości 240 g na tydz. (co odpowiada dobowej dawce wynoszącej około 34 g) przez 5 m-cy (maksymalna zalecana dawka wynosi 15 g/dobę), rozwinął się w trakcie leczenia zespół Cushinga oraz łuszczyca krostkowa po nagłym przerwaniu leczenia.DziałanieKalcypotriol jest analogiem wit. D. Dane z badań in vitro wskazują, że kalcypotriol indukuje różnicowanie keratynocytów oraz hamuje ich proliferację. Taka podstawa jego działania sugerowana jest w leczeniu łuszczycy. Betametazonu dipropionian, podobnie jak inne kortykosteroidy, działa miejscowo przeciwzapalnie, przeciwświądowo, zwężająco na naczynia krwionośne oraz immunosupresyjnie, jednak nie leczy choroby podstawowej. Zastosowanie opatrunku okluzyjnego może nasilać jego działanie ze względu na zwiększenie przenikania produktu leczniczego przez warstwę rogową. W związku z tym następuje zwiększenie częstości występowania działań niepożądanych. Ogólnie biorąc, mechanizm działania przeciwzapalnego steroidów stosowanych miejscowo nie jest jasny.Skład1 g żelu zawiera 50 mg kalcypotriolu (w postaci kalcypotriolu jednowodnego) i 0,5 mg betametazonu (w postaci betametazonu dipropionianu).

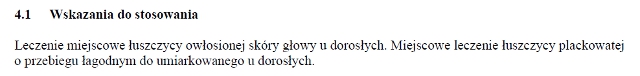








 Laktacja
Laktacja Ciąża - trymestr 1 - Kategoria C
Ciąża - trymestr 1 - Kategoria C Ciąża - trymestr 2 - Kategoria C
Ciąża - trymestr 2 - Kategoria C Ciąża - trymestr 3 - Kategoria C
Ciąża - trymestr 3 - Kategoria C Wykaz B
Wykaz B



Komentarze
[ z 0]